SENYAWA ORGANOMETALIK
Senyawa organologam adalah
senyawa di mana atom-atom karbon dari gugus organik terikat kepada atom logam.
Contoh, suatu aloksida seperti (C3H7O)4Ti
tidaklah dianggap sebagai suatu senyawa organologam karena gugus organiknya
terikat pada Ti melalui oksigen, sedangkan C6H5Ti(OC3H7)3 karena
terdapat satu ikatan langsung antara karbon C dari gugus fenil dengan logam Ti.HH Istilah organologam biasanya didefenisikan agak longgar, dan senyawaan
dari unsur-unsur seperti Boron, fosfor, dan silikon semuanya mirip logam. Tetapi untuk senyawa yang mengandung
ikatan antara atom logam dengan oksigen, belerang, nitrogen, ataupun dengan
suatu halogen tidak termasuk sebagai senyawa organologam. Dari bentuk ikatan
pada senyawa organologam, senyawa ini dapat dikatakan sebagai jembatan antara
kimia organik dan anorganik..
Pada dasarnya senyawa organologam ini muatan karbon
negatif atau polarized sehingga nukleofilik kemudian reaksi dengan karbon
elektrofiliknya dapat membuatikatan karbon-karbon.
Jadi
dapat disimpulkan Nukleofilik=bermuatan
positif sedangkan elektrofilik= bermuatan negatif
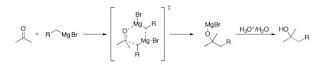
Reaksi Grignard adalah suatu reaksi kimia organologam yang
mana alkil, vinil, atau aril-magnesiumhalida (pereaksi Grignard) ditambahkan ke dalam gugus karbonil dari suatu aldehida atau keton. Reaksi ini adalah suatu cara penting
untuk pembuatan ikatan
karbon–karbon. Reaksi
antara suatu halida organik dengan magnesium bukan reaksi Grignard, tetapi menghasilkan
pereaksi Grignard
Pereaksi
Grignard dibuat melalui reaksi antara alkil atau aril halida dengan logam magnesium. Reaksi dilakukan dengan penambahan halida organik
ke dalam suspensi magnesium dalam pelarut eter,
yang menghasilkan ligan yang diperlukan
untuk menstabilkan senyawa organomagnesium. Bukti empiris menunjukkan bahwa
reaksi berlangsung pada permukaan logam. Reaksi berlangsung melalui transfer elektron tunggal: Dalam reaksi pembentukan
Grignard, radikal bebas dapat dikonversi menjadi karbanion melalui transfer
elektron kedua.
R−X
+ Mg → R−X•− + Mg•+
R−X•− →
R• + X−
R• +
Mg•+ → RMg+
RMg+ +
X− → RMgX
Keterbatasan
pereaksi Grignard adalah bahwa mereka tidak segera bereaksi dengan alkil halida
melalui mekanisme SN2. Di lain pihak, mereka segera mengendap
melalui reaksi transmetalasi:
Untuk
kegunaan ini, pereaksi Grignard komersial sangat berguna karena dapat
menghindari masalah pada tahap inisiasi.
Grignard Dengan halida organik
Pereaksi
Grignard tidak bereaksi dengan halida organik, berlawanan
dengan golongan halida utama lainnya yang memiliki reaktivitas tinggi. Nsmun,
dengan adanya katalis logam metal catalysts, pereaksi Grignard berperan
dalam reaksi penggandengan C-C.
Sebagai contoh, nonilmagnesium bromida bereaksi dengan metil p-klorobenzoate
menghasilkan asam p-nonilbenzoat, dengan adanya Tris(asetilasetonato)besi(III) (Fe(acac)3),
setelah direaksikan dengan NaOH untuk menghidrolisis ester,
seperti terlihat di bawah. Tanpa Fe(acac)3, pereaksi Grignard akan
menyerang gugus ester melalui aril halida



Tidak ada komentar:
Posting Komentar